Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir?
Kimyasal reaktiflik Nedir?
Kimyasal reaktiflik Nedir?, Kimyasal reaktiflik Nerededir?, Kimyasal reaktiflik Hakkında Bilgi?, Kimyasal reaktiflik Analizi? Kimyasal reaktiflik ilgili Kimyasal reaktiflik ile ilgili bilgileri sitemizde bulabilirsiniz. Kimyasal reaktiflik ile ilgili daha detaylı bilgi almak ve iletişime geçmek için sayfamıza tıklayabilirsiniz. Kimyasal reaktiflik Ne Anlama Gelir Kimyasal reaktiflik Anlamı Kimyasal reaktiflik Nedir Kimyasal reaktiflik Ne Anlam Taşır Kimyasal reaktiflik Neye İşarettir Kimyasal reaktiflik Tabiri Kimyasal reaktiflik Yorumu
Kimyasal reaktiflik Kelimesi
Lütfen Kimyasal reaktiflik Kelimesi İle ilgili Daha Fazla Bilgi Almak İçin Kategoriler Sayfamıza Bakınız. Kimyasal reaktiflik İlgili Sözlük Kelimeler Listesi Kimyasal reaktiflik Kelimesinin Anlamı? Kimyasal reaktiflik Ne Demek? ,Kimyasal reaktiflik Ne Demektir? Kimyasal reaktiflik Ne Demektir? Kimyasal reaktiflik Analizi? , Kimyasal reaktiflik Anlamı Nedir?,Kimyasal reaktiflik Ne Demektir? , Kimyasal reaktiflik Açıklaması Nedir? ,Kimyasal reaktiflik Cevabı Nedir?,Kimyasal reaktiflik Kelimesinin Anlamı?,Kimyasal reaktiflik Kelimesinin Anlamı Nedir? ,Kimyasal reaktiflik Kelimesinin Anlamı Ne demek?,Kimyasal reaktiflik Kelimesinin Anlamı Ne demektir?
Kimyasal reaktiflik Bu Kelimeyi Kediniz Aradınız Ve Bulamadınız
Kimyasal reaktiflik Kelimesinin Anlamı Nedir? Kimyasal reaktiflik Kelimesinin Anlamı Ne demek? , Kimyasal reaktiflik Kelimesinin Anlamı Ne demektir?
Demek Ne Demek, Nedir? Tdk'ye Göre Anlamı
Demek kelimesi, dilimizde oldukça kullanılan kelimelerden birisidir. TDK'ye göre, demek kelimesi anlamı şu şekildedir:
Söylemek, söz söylemek - Ad vermek - Bir dilde karşılığı olmak - Herhangi bir ses çıkarmak - Herhangi bir kanıya, yargıya varmak - Düşünmek - Oranlamak - Ummak, - Erişmek - Bir işe kalkışmak, yeltenmek - Saymak, kabul etmek - bir şey anlamına gelmek - öyle mi, - yani, anlaşılan - inanılmayan, beklenmeyen durumlarda kullanılan pekiştirme veya şaşma sözü
Kimyasal reaktiflik Bu Kelimeyi Kediniz Aradınız Ve Bulamadığınız İçin Boş Safyadır
Demek Kelimesi Cümle İçerisinde Kullanımı
Eskilerin dediği gibi beşer, şaşar. - Muşmulaya döngel de derler.
Kamer `ay` demektir. - Küt dedi, düştü. - Bu işe herkes ne der? - Güzellik desen onda, zenginlik desen onda. - Bundan sonra gelir mi dersin? - Saat yedi dedi mi uyanırım. - Kımıldanayım deme, kurşunu yersin. Ağzını açayım deme, çok fena olursun. - Yarım milyon dediğin nedir? - Okuryazar olmak adam olmak demek değildir. - Vay! Beni kovuyorsun demek, pekâlâ! Kimyasal reaktiflik - Demek gideceksin.
Demek Kelimesi Kullanılan Atasözü Ve Deyimler
- dediği çıkmak - dediğinden (dışarı) çıkmak - dediğine gelmek
- dedi mi - deme! - demediğini bırakmamak (veya koymamak) - deme gitsin - demek istemek , - demek ki (veya demek oluyor ki) , - demek olmak , - dememek - der oğlu der - deyip de geçmemek - diyecek yok - dediği çıkmak , {buraya- - dediğinden (dışarı) çıkmak - dediğine gelmek i, - dedi mi , {buraya- - deme! - demediğini bırakmamak (veya koymamak) - deme gitsin , - demek istemek - demek ki (veya demek oluyor ki) - demek olmak - dememek - der oğlu der - deyip de geçmemek - diyecek yok
Kimyasal reaktiflik
Kimyasal reaktiflik Nedir? Kimyasal reaktiflik Ne demek? , Kimyasal reaktiflik Kelimesi İle ilgili Daha Fazla Bilgi , Almak İçin Kategoriler Sayfamıza Bakınız. İlgili Sözlük Kelimeler Listesi
Kimyasal reaktiflik Kelimesinin Anlamı? Kimyasal reaktiflik Ne Demek? Kimyasal reaktiflik Ne Demektir? ,Kimyasal reaktiflik Analizi? Kimyasal reaktiflik Anlamı Nedir? Kimyasal reaktiflik Ne Demektir?, Kimyasal reaktiflik Açıklaması Nedir? , Kimyasal reaktiflik Cevabı Nedir? , Kimyasal reaktiflik Kelimesinin Anlamı?
Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir?
Kimyasal reaktiflik
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar.[1] Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir.[2] Dolayısıyla kimyasal bileşik oluşturmaları zordur.[3] Bu durum soygazların tam dolu olan en dış elektron kabuğundan (valance kabuğu) dolayıdır.[4]
Kimyasal denge, asit ve baz kimyası, elektron aktarımı tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.
Kimyasal Reaktiflik-Temel Kavramlar[değiştir | kaynağı değiştir]
Kimyasal denge, asit ve baz kimyası, oksidasyon (yükseltgenme) ve redüksiyon (indirgenme) tepkimeleri kimyasal reaktifliğin anlaşılmasında önem teşkil ederken, entropi, entalpi ve Gibbs serbest enerjisi gibi kavramlar bir kimyasal reaksiyonun gerçekleşme eğiliminin dolayısıyla kimyasal reaktiflik kavramının açıklanmasında belirleyici rol oynar.
Kimyasal Denge[değiştir | kaynağı değiştir]

Soldaki resim 6-methylpentacene ve 6-methylene-6,13-dihydropentacene arasında gerçekleşmiş olan kimyasal bir tepkimenin denge durumunu göstermektedir.
Kimyasal denge bir kimyasal reaksiyonda tepkimeye giren ve tepkime sonucu oluşan maddelerin derişimlerinde yeterli bir zaman diliminde değişme olmadığı zaman oluşan durumu adlandırmak için kullanılır.[5] Eğer bu durum ileri tepkime ve geri tepkimenin hızlarının birbirine eşit olması sonucu gerçekleşiyorsa bu durum dinamik kimyasal denge olarak adlandırılır.[6]

Kimyasal denge genel olarak aşağıdaki gibi ifade edilebilir;
Burada ;
- a,b,c ve d katsayılar,
- A ve B reaktantlar,
- C ve D tepkime sonucu çıkan ürünler
- ve iki yönü de işaret eden ok da
tepkimenin iki yönde de ilerlediğini ifade etmek için kullanılmaktadır.
Sistemler kimyasal ya da fiziksel tabiyatlı olsun dengeye ulaşma eğilimi gösterirler. Hiçbir kimyasal reaksiyon kendiliğinden kimyasal dengeden uzaklaşma eğilimi gösteremez.[7] Dolayısıyla dengeye ulaşmış bir reaksiyonun devam edebilmesi için dışarıdan müdahale edilmeye ihtiyacı vardır.[8]
Kimyasal Denge Sabiti[değiştir | kaynağı değiştir]
Denge durumundaki kimyasal bir tepkime aşağıdaki gibi verilebir;
Termodinamik denge sabiti [9][10]
-
şeklinde tanımlanabilir
Gibbs serbest enerjisi bakımından denge sabiti;
şeklinde tanımlanır.
Asit ve Baz Kimyası[değiştir | kaynağı değiştir]
Asit baz reaksiyonu basitce bir asitle bir baz arasında gerçekleşen reaksionları adlandırmak için kullanılır. Bu reaksiyonların mekanizmaları göze alındığında birçok farklı tanımlama mevcuttur. Asit ve bazlarla ilgili ilk kapsamlı bilimsel tanımlama Fransız kimyager Antoine Lavoisier tarafından sağlanmıştır.[11]
Asit[değiştir | kaynağı değiştir]
- Çeşitli Asitler ve kimyasal Gösterim Şekilleri.
-
Genel Karboksil Asit Gösterimi
-
Benzoik Asit
-
Kare Asit
-
Hidrofosforik Asit
-
Pivalik Asit
Asitin farklı şekillerde tanımlanması mümkündür. Bu tanımların bazıları;
- Arrhenius tanımına göre asit suda çözüldüğünde hidrojen iyonunun (H3O+)konsantrasyonunu artıran maddedir.[12]
- Bronsted-Lowry tanımına göre asit proton (H+) bırakan maddelere denir.[13]
- Lewis tanımına göre asit, H+ iyonu gibi, çözeltiden elektron eksilten maddelere denir.[14]
Asitlerin genel özellikleri şöyle sıralanabilir;
- Ekşimsi bir tada sahiptirler
- Bazlarla nötralizasyon reaksiyonuna girerler
- Aktif metallerle korrazyon reaksiyonuna girerler [15]
Baz[değiştir | kaynağı değiştir]
- Çeşitli Bazlar ve kimyasal Gösterim Şekilleri.
-
Sodyum Hidroksid
-
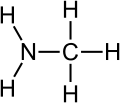
Ammonia
-
Metilamin
Bazlarında asitler gibi farklı tanımları mevcuttur.
- Arrhenius Bazları suda çözüldüğünde OH- iyonlarının konsantrasyonunu artıran bileşiklere denilmektedir.
- NaOH(aq)Na(aq)++OH(aq)-
- Bronsted-Lowry tanımına göre bazlar çözeltiden proton azaltan moleküllerdir.
- HCl(aq)+NH3(aq)NH4++Cl-
Bu tanımlamaya göre hidroklorik asit (HCl) amonia (NH3)'ya bir proton verdiği için Bronsted-Lowry asidi diğer taraftan amonia ise proton eksiltiği için Bronsted-Lowry bazıdır.
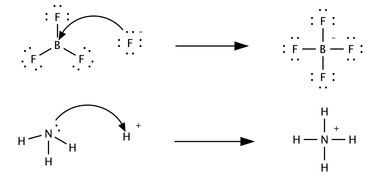
- Lewis Teorisine göre ise bazlar electron veren maddelerdir. Diğer tanımlardan farklı olarak sadece elektron alışverişi üzerine kurulmuş bir tanımlamadır.[16]
- NH3+BF3H3NBF3
Bu reaksiyon ammonia ve boron trifluoride arasındadır. Hidrojen atomu transferi söz konusu olmadığından dolayı, bu örnek reaksiyon Lewis asit-baz reaksiyonudur.
Asit ve Baz Reaksiyonları[değiştir | kaynağı değiştir]

Asitlik bazlık değerine göre renk değişimi gözlemi
en sol asidik
Orta: nötral
Sağ Bazik
Hidroklorik asit ve sodyum hidroksit'in tepkimesi kuvvetli asit-baz reaksiyonlarına en temel örnektir. Öte yandan sitrik asit ve bikarbonate iyonu kimyasal tepkimesi zayıf asit-baz reaksiyonuna örnektir. Genel olarak 4 çeşit asit baz reaksiyonu vardır.
- a)Kuvvetli Asit Kuvvetli Baz reaksiyonu
- Kuvvetli asitle kuvvetli baz arasında gerçekleşen reaksiyondur. HCl ve NaOH sırasıyla kuvvetli asit ve bazdır dolayısıyla birlikte girecekleri tepkimede kuvvetli asit kuvvetli baz reaksiyonudur.[17]
- HCl(aq) + NaOH(aq) H2O(l) + NaCl(aq)
- HCl ve NaOH tümüyle iyonlaştıkları için yukarıdaki tepkime yeniden aşağıdaki gibi yazılabilir;
- H+(aq) + Cl-(aq) + Na+(aq) + OH-(aq) H2O(l) + Na+(aq) + Cl-(aq)
- b)Zayıf Asit Kuvvetli Baz reaksiyonu
- Zayıf bir asitle kuvvetli bir baz arasındaki tepkimedir. Zayıf asitler suda iyonlarına az miktarda çözünürler. Zayıf asit güçlü bazla tepkimeye girdiğinde zayıf asitten gelen H+ iyonu kuvvetli bazdan gelen OH- iyonuna transfer olur bunun sonucunda da su ve tuz oluşumu gerçekleşir. Bununla birlikte bu tepkimelerden oluşan tuz genellikle suda çözünebilme özelliğine sahiptir.
- HCO2H(aq) + OH-(aq) H2O(ℓ) + HCO2-(aq)
- c)Kuvvetli Asit Zayıf Baz reaksiyonu
- Kuvvetli asit zayıf baz reaksiyonuna HCl ve NH3'ün tepkimesi verilebilir.
- H3O+(aq) + N3(aq) (aq) H2O(ℓ) + NH4+(aq)
- d)Zayıf Asit Zayıf Baz reaksiyonu
- Asetik asit ve ammonia'nın reaksiyonu buna örnektir.
- CH3CO2H(aq) + NH3(aq) NH4+(aq)+CH3CO2-
Entropi[değiştir | kaynağı değiştir]

Entropi bir sistemin ısı enerjisini mekanik enerjiye dönüştürememesine yetkinliğinin bir ölçüsüdür, sıklıkla bir sistemin düzensizliğinin ve raslantısallığının derecesi olarak da algılanmaktadır.[18] Bir kimyasal reaksiyonun gerçekleşmesinde entropi entalpi ile belirleyicidir.[19] Genel olarak gerçekleşmesi durumunda bir tepkime eğer sistemin entropisini artıracak yöndeyse o tepkime gerçekleşmeye eğilimlidir denir. Diğer taraftan gerçekleşmesi durumunda bir tepkime eğer egzotermik ise diğer bir deyişle entalpi azalırsa o tepkime gerçekleşmeye eğilimlidir denir.[20] Sıcak bir metal soğuk su içine konulduğunda soğumaya başlamasının kendiliğinden (sisteme dış bir müdahale yapılmadan) gerçekleşmesi entalpi eğilimli fiziksel tepkimeye örnektir. Entropi eğilimli tepkimelere ise aşağıdaki örnekler verilebilir;
- Maddenin katı halden sıvı hale geçmesi
- Gazların daha geniş bir hacime yayılması
- Mol sayısını artıran kimyasal reaksiyonlar
Bu örneklerin hepsinde entropide artış gözlenir. Entropi "S" harfi ile gösterilir. Bir kimyasal tepkimenin entropisindeki değişiklik;
- ΔrS° = ΣnS°(ürünler) − ΣnS°(reactants)
formülü ile ifade edilir. Bir reaksiyonun kendiliğinden gelişebilmesi için sistemin ve çevresinin entropisinin toplamında artış gözlenmesi gerekmektedir (Termodinamiğin 2. kanunu).[21] Aşağıdaki gibi ifade edilir;
- ΔS°(evren) = ΔS°(sistem) + ΔS°(çevre)
| Entalpi (ΔH°) | Entropi (ΔS°) | Kendiliğinden gerçekleşmesi |
|---|---|---|
| Egzotermik | >0 | ΔS°(evren) > 0 (her koşulda gerçekleşir) |
| Egzotermik | <0 | ΔS° ve ΔH° in farkına bağlıdır (düşük sicaklıklarda gerçekleşir). |
| Endotermik | <0 | ΔS°(evren) < 0. (Kendiliğinden gerçekleşemez). |
Gibbs Enerjisi[değiştir | kaynağı değiştir]

Gibbs serbest enerjisi 1870'li yıllarda Josiah Willard Gibbs tarafından bir sürecin sabit bir basınç ve sıcaklık koşullarında kendiliğinden gerçekleşip gerçekleşemeyeceğini tahmin etmek amacıyla tanımlanmıştır.[22] Gibbs enerjisi(G) iş yapabilme enerjisine dönüşebilecek kimyasal reaksiyon enerjisiyle ilgilidir. Bir sistemin Gibbs enerjisi sistemin entalpisi(H), sistemin entropisi(S) ve sicaklığının (T) bir işlevidir.[23] Matematiksel olarak Gibbs enerjisi aşağıdaki gibi ifade edilir;
- G=H-TS
Gibbs enerjisindeki değişim;
- ΔG = ΔH − TΔS
Standart koşullarda Gibbs enerjisindeki değişim;
- ΔG° = ΔH° − TΔS°
eşitliğiyle ifade edilir.[24] Bir reaksiyonun Gibbs enerjisi;
- ΔrG°
şeklinde ifade edilir.
Gibbs serbest enerjisi entropi ve entalpinin bir fonksiyonu olduğundan dolayı bir reaksiyonun kendiliğinden gelişip gelişemeyeceği hakkında bilgi içerir. Eğer bir reaksiyonun Gibbs serbest enerjisi < 0 ise o reaksiyon kendiliğinden gerçekleşir. Diğer taraftan eğer tepkimenin Gibbs serbest enerjisi sıfırdan büyük ise o reaksiyonun gerçekleşmesi için dış müdahale gereklidir. Gibbs serbest enerjisinin sıfıra eşit olduğu durum ise kimyasal denge durumunu belirtmektedir.
| ΔrG° | Kendiliğinden gerçekleşmesi |
|---|---|
| ΔrG° < 0 | Reaksiyon kendiliğinden gerçekleşir (standard koşullarda) |
| ΔrG° = 0 | Reaksiyon dengededir (standard koşullarda) |
| ΔrG° > 0 | Reaksiyon kendiliğinden gerçekleşmez (standard koşullarda) |
Elektron Transfer Reaksiyonları[değiştir | kaynağı değiştir]

Bir bakır parçasının gümüş nitrat sulu çözeltisine eklendiğinde meydana gelen reaksiyon elektron transfer reaksiyonlarına basit bir örnektir. Bu örnekte oluşan reaksiyon
- Cu(s) + 2 Ag+(aq) → Cu2+(aq) + 2 Ag(s)
şeklinde ifade edilir. Bakır (Cu)'dan gelen elektronların gümüş(Ag)'e geçmesiyle elektron transfer reaksiyonu gerçekleşmiş olur. Bakır ve gümüş iyonları direkt temas halinde olduklarında bu reaksiyon sonucu ısı üretilir. Eğer doğrudan değil de basit bir elektrik devresi vasıtasıyla temas halinde olurlarsa elektron transferi reaksiyonu neticesinde elektrik üretilmiş olur. Bu çeşit kendiliğinden gelişen kimyasal tepkimelerden oluşan enerjiyi elektrik üretmede kullanan aletlere Galvanik ya da Voltaik cell denir.[25]
Oksidasyon-Azaltma (Redoks) Reaksiyonu[değiştir | kaynağı değiştir]

Redoks reaksiyonları ya da oksidasyon-azalma tepkimeleri asit-baz reaksiyonlarına benzemektedir ve temelde bir elektron transfer reaksiyonudur. Oksidasyon ve azaltma reaksiyonu birlikte gerçekleşir. Oksidasyon elektron kaybını, diğer taraftan azaltma elektron kazanımını ifade etmektedir.[26] Tüm elektron transfer tepkimelerinin genel özellikleri
- Bir reaktan okside olur, bir reaktant azaltılır,
- Oksidasyon ve azaltma dengede bir şekilde ilerlemek zorundadır,
- Okside eden madde azalır,
- Azaltan madde okside olur
şeklinde sıralanabilinir.
- Cu(s)+2Ag+(aq)→ Cu2+(aq)+2 Ag(s)
Reaksiyonunda Cu okside olmuştur dolayısıyla azaltan maddedir. Diğer taraftan Ag azaltılmıştır dolayısıyla okside edici maddedir.
Ayrıca bakınız[değiştir | kaynağı değiştir]
Dış bağlantılar[değiştir | kaynağı değiştir]
- Kimyasal Reaktiflik (İngilizce) 15 Haziran 2012 tarihinde Wayback Machine sitesinde arşivlendi.
- Reaksiyon Mekanizması (İngilizce)
- Kimyasal Denge (İngilizce)
- Kimyasal Denge
- Asit Baz Teorisi
- Entropi ve Entalpi
Kaynakça[değiştir | kaynağı değiştir]
- Townsend, John C. Kotz, Paul M. Treichel, John R.. Chemistry & chemical reactivity (8th ed. bas.). Belmont, CA: Brooks/Cole, Cengage Learning. ISBN 0-8400-48289.
- [et (2010) al.], Ralph H. Petrucci ... . General chemistry : principles and modern applications (10th ed. bas.). Toronto: Pearson Prentice Hall. ISBN 978-0-13-206452-1.
- Paula, Peter Atkins, Julio de (2002). Atkins' physical chemistry (7th ed. bas.). New York: Oxford University Press. ISBN 9780198792857.
- Chipinda, I; Hettick, JM; Siegel, PD (2011). "Haptenation: chemical reactivity and protein binding.". Journal of allergy 2011: 839682. PMID 21785613
- Türker, Lemi (1 Ocak 2012). "A Model Study on the Possible Effects of an External Electrical Field on Enzymes Having Dinuclear Iron Cluster [2Fe-2S]". The Scientific World Journal 2012: 1–9. doi:10.1100/2012/985958
- Klopman, Gilles. (1 Ocak 1968). "Chemical reactivity and the concept of charge- and frontier-controlled reactions". Journal of the American Chemical Society 90 (2): 223–234. doi:10.1021/ja01004a002.
Dipnotlar[değiştir | kaynağı değiştir]
- ^ "Reactivity and Atomic Structure" (PDF). chem.ucla.edu. 16 Haziran 2015 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Noble Gases". chemicalelements.com. 2 Temmuz 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Noble Gases". britannica.com/. 30 Nisan 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Group 18". chemwiki.ucdavis.edu. 21 Nisan 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Chemical Equilibria". pages.towson.edu/. 2 Mayıs 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Dynamic Equilibrium". chemwiki.ucdavis.edu. 29 Temmuz 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Chemical Eq" (PDF). learnquebec.ca/. 25 Kasım 2010 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 24 Kasım 2012.
- ^ "Chemical Equilibrium". 3 Mayıs 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Kasım 2012.
- ^ F.J,C. Rossotti and H. Rossotti, The Determination of Stability Constants, McGraw-Hill, 1961. p. 5
- ^ IUPAC Green Book, 3rd edition, p58 pdf 4 Mart 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Miessler, G.L., Tarr, D. A., "Inorganic Chemistry" (1991) p. 166
- ^ "Acid". intro.chem.okstate.edu. 3 Mayıs 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Asit". files.chem.vt.edu/. 22 Şubat 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Lewis". /chemed.chem.purdue.edu/. 6 Temmuz 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Acid". .chemtutor.com. 13 Ağustos 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Kasım 2012.
- ^ "Acids_and_Bases". chemwiki.ucdavis.edu. 3 Ocak 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Tiltration". chemwiki.ucdavis.edu. 23 Haziran 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Entropy". oxforddictionaries.com. 27 Haziran 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Reactivity". employees.csbsju.edu. 3 Temmuz 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "Enthalpy". faculty.ncc.edu. 5 Şubat 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "2nd law". Nasa. 22 Haziran 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2012.
- ^ "gibbs-free-energy". 7 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Kasım 2012.
- ^ "Gibbs Free Energy". hyperphysics.phy-astr.gsu.edu. 18 Mayıs 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Kasım 2012.
- ^ "Gibbs Free Energy". chem.tamu.edu. 9 Mayıs 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Kasım 2012.
- ^ "Galvanic-Cells". chemed.chem.wisc.edu. 26 Ocak 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Kasım 2012.
- ^ "Redox Reaction". shodor.org. 29 Haziran 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Kasım 2012.
Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Nedir? :Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? ile ilgili Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? burada bulabilirsiniz. Detaylar için sitemizi geziniz Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Ne Demektir? Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Açıklaması Nedir? Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Cevabı Nedir? Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Kelimesinin Anlamı? Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? konusu Nedir Ne, yaşantımızda sık kullanılan kelimelerden birisi olarak karşımıza çıkar. Hem sosyal medyada hem de gündelik yaşantıda kullanılan ne kelimesi, uzun yıllardan beri dilimizdedir. Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Türk Dil Kurumu na (TDK) göre farklı anlamları olan ne kelimesi, Türkçe de tek başına ya da çeşitli cümleler eşliğinde kullanılabilir. Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Ne kelimesi ne demek, TDK ya göre anlamı nedir sorularının cevabını arayanlar için bildiris.com doğru adres! Peki, ne kelimesi ne demek, TDK ye göre anlamı nedir? Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Ne kelimesinin kökeni ne, ne kelimesinin kaç anlamı var? Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? İşte TDK bilgileri ile merak edilenler
Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Açıklaması? :Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Açıklama Bir Terim Kavram Ya Da Başka Dilsel Olgunun Daha İyi Anlaşılması İçin Yapılan Ek Bilgidir.Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Söz Konusu Bilgi Açıklanacak Sözcükten Daha Uzun Olur Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Açıklama İle İlgili Durumun Kanıtı Şu Şekilde Doğrulanabilir Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Bir Sözlükteki Tanım İlgili Sözcük Yerine Kullanılabilirse, Bu Bir Açıklamadır. Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Yani Aynı Bağlam İçinde Hem Sözcük Hem De Tanım Kullanılırsa Ve Anlamsal Açıdan Bir Sorun Oluşturmuyorsa Bu Bir Açıklamadır.
Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Gerçek mi? :Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? ile ilgili Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? burada bulabilirsiniz. Detaylar için sitemizi geziniz Gerçek anlam Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? sözcüklerin birincil anlamı ile (varsa) bu anlamla doğrudan ilişkili olan anlamlarıdır. Gerçek anlam, temel anlam ile yan anlamların bileşkesidir. Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Bir sözcüğün mecaz olmayan tüm anlamlarını kapsar.
Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Hakkında? :Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? ile ilgili Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? burada bulabilirsiniz. Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Detaylar için sitemizi geziniz Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? Bu sayfada Hakkında nedir Hakkında ne demek Hakkında ile ilgili sözler cümleler bulmaca kısaca Hakkında anlamı tanımı açılımı Hakkında hakkında bilgiler Kimyasal reaktiflik nedir?, Kimyasal reaktiflik anlamı nedir?, Kimyasal reaktiflik ne demektir? resimleri Hakkında sözleri yazıları kelimesinin sözlük anlamı nedir almanca ingilizce türkçe çevirisini bulabilirsiniz
Ayhan Özçelik Kimdir?, Toplanık Nedir?, İzzet Kaplan Kimdir?, Mühip Kanko Kimdir?, Prensin Bayrağı Anlamı Nedir, Prensin Bayrağı Nasıl Oluştu, Prensin Bayrağı Tarihi, Prensin Bayrağı Renkleri, Prensin Bayrağı Tasarımı, Recep Bozdemir Kimdir?, Ali Topçu Kimdir?, Toparlakça Nedir?, Hurşit Çetin Kimdir?, Fadik Temizyürek Kimdir?, Toparlağımsı Nedir?, Toparlacık Nedir?, Osmanlı bayrağı Anlamı Nedir, Osmanlı bayrağı Nasıl Oluştu, Osmanlı bayrağı Tarihi, Osmanlı bayrağı Renkleri, Osmanlı bayrağı Tasarımı, Ülkü Doğan Kimdir?, Mehmet Akif Perker Kimdir?, Necmi Özgül Kimdir?, Top Sakallı Nedir?, Hasan Daşkın Kimdir?, Hasan Memişoğlu Kimdir?, Nazi Almanyası bayrağı Anlamı Nedir, Nazi Almanyası bayrağı Nasıl Oluştu, Nazi Almanyası bayrağı Tarihi, Nazi Almanyası bayrağı Renkleri, Nazi Almanyası bayrağı Tasarımı, Fitopatolojik Nedir?, Öztürk Keskin Kimdir?, Şeref Baran Genç Kimdir?, Tonla Nedir?, Nuran Ergen Kılıç Kimdir?, Fitne Kumkuması Nedir?, Filiz Orman Akın Kimdir?, Tombulca Nedir?, Fitne Fücur Nedir?, Zürriyetsiz İsminin Anlamı Nedir?, Fitilsiz Nedir?, Natalia Cumhuriyeti Bayrağı Anlamı Nedir, Natalia Cumhuriyeti Bayrağı Nasıl Oluştu, Natalia Cumhuriyeti Bayrağı Tarihi, Natalia Cumhuriyeti Bayrağı Renkleri, Natalia Cumhuriyeti Bayrağı Tasarımı, Zürriyetli İsminin Anlamı Nedir?, Mustafa Süleyman Kurtar Kimdir?, Züppe İsminin Anlamı Nedir?, Fitilci Nedir?, Dağıstan Budak Kimdir?, Yrd Doç Dr Bilge Gökçen Röhlig Kimdir? Yrd Doç Dr Bilge Gökçen Röhlig Nereli Yrd Doç Dr Bilge Gökçen Röhlig Kaç Yaşında?, Zümrüdi İsminin Anlamı Nedir?, Tolgasız Nedir?, Fitçi Nedir?, Hatice Gül Bingöl Kimdir?, Gökhan Baylan Kimdir?, Zülüflü İsminin Anlamı Nedir?, Tolgalı Nedir?, Fişlik Nedir?, Kampuçya Halk Cumhuriyeti bayrağı Anlamı Nedir, Kampuçya Halk Cumhuriyeti bayrağı Nasıl Oluştu, Kampuçya Halk Cumhuriyeti bayrağı Tarihi, Kampuçya Halk Cumhuriyeti bayrağı Renkleri, Kampuçya Halk Cumhuriyeti bayrağı Tasarımı, Toleranssız Nedir?, Züllü İsminin Anlamı Nedir?, Fişli Nedir?, Fişeksiz Nedir?, Zülcelâl İsminin Anlamı Nedir?, Sözdar Akdoğan Kimdir?, Murat Turna Kimdir?, Fahri Özkan Kimdir?, Zührevi İsminin Anlamı Nedir?, Fişekli Nedir?, Züğürt İsminin Anlamı Nedir?, İzmir bayrağı Anlamı Nedir, İzmir bayrağı Nasıl Oluştu, İzmir bayrağı Tarihi, İzmir bayrağı Renkleri, İzmir bayrağı Tasarımı, Filiz Çelik Kimdir?, Toksikolojik Nedir?, Fistolu Nedir?, Koray Önsel Kimdir?, Zübük İsminin Anlamı Nedir?, Toksik Nedir?, Fikret Tufanyazıcı Kimdir?, Zulmeden İsminin Anlamı Nedir?, Fistansız Nedir?, İlker Yücel Kimdir?, Tokatlı Nedir?, Zömbe İsminin Anlamı Nedir?, Gadsden bayrağı Anlamı Nedir, Gadsden bayrağı Nasıl Oluştu, Gadsden bayrağı Tarihi, Gadsden bayrağı Renkleri, Gadsden bayrağı Tasarımı, Tokalı Nedir?, Selma Sarıcıoğlu Çalışkan Kimdir?, Zottiri İsminin Anlamı Nedir?, Ümit Duman Kimdir?, Zot İsminin Anlamı Nedir?, Bahadır Gökmen Kimdir?, Berrin Selbuz Kimdir?, Tok Sözlü Nedir?, Fiskal Nedir?, Zorunlu İsminin Anlamı Nedir?, Zorlu İsminin Anlamı Nedir?, Toimeton Nedir?, Ömer Eldemir Kimdir?, Demokratik Kampuçya bayrağı Anlamı Nedir, Demokratik Kampuçya bayrağı Nasıl Oluştu, Demokratik Kampuçya bayrağı Tarihi, Demokratik Kampuçya bayrağı Renkleri, Demokratik Kampuçya bayrağı Tasarımı, Kürşat Özer Kimdir?, Zorlayıcı İsminin Anlamı Nedir?, Sertaç Çelikkaleli Kimdir?, Zorlamasız İsminin Anlamı Nedir?, Togolu Nedir?, Kenan Çarboğa Kimdir?, Zorlama İsminin Anlamı Nedir?, Bizans İmparatorluğu bayrakları ve sembolleri Anlamı Nedir, Bizans İmparatorluğu bayrakları ve sembolleri Nasıl Oluştu, Bizans İmparatorluğu bayrakları ve sembolleri Tarihi, Bizans İmparatorluğu bayrakları ve sembolleri Renkleri, Bizans İmparatorluğu bayrakları ve sembolleri Tasarımı, Burak Ustalı Kimdir?, Zorca İsminin Anlamı Nedir?, Zorba İsminin Anlamı Nedir?, İlker İpek Kimdir?, Gülcan Alp Kimdir?, Zoraki İsminin Anlamı Nedir?,



![{\displaystyle K_{c}={\frac {{[R]}^{\rho }{[S]}^{\sigma }...}{{[A]}^{\alpha }{[B]}^{\beta }...}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/509287830ec8369ae2a6cb4317cbe0c04c475fd1)